非小细胞肺癌药物Tagrisso作为早期辅助治疗,可将中枢神经系统复发的风险降低82%
英国阿斯利康9月19日,塔古里索(Tagurisso)(通用名称:Oshimeruchinibu)通过第三阶段ADAURA试验中预先定义的探索性分析,在早期(IB期,II期和IIIA期)完全切除分期)作为上皮生长因子受体基因突变阳性(EGFRm)非小细胞肺癌(NSCLC)患者的术后辅助治疗,中枢神经系统(CNS)无病生存(DFS )的临床显着改善宣布已完成。该研究结果于9月19日在2020年欧洲临床肿瘤学会(ESMO)年度会议(虚拟会议)的总统座谈会上宣布,同时,主要结果发表在《新英格兰医学杂志》上。它已过帐。
Tagrisso是第三代不可逆EGFR抑制剂,还具有抗中枢神经系统转移的临床活性。目前,每日一次口服Tagrisso 40 mg和80 mg片剂是EGFR基因突变阳性晚期NSCLC的一线治疗,包括EGFR T790M基因突变阳性晚期NSCLC在内的许多治疗剂包括美国,日本,中国和欧盟。在国内批准。
目前,没有任何国家批准Tagrisso作为术后辅助治疗。2020年7月,塔格里索(Tagrisso)在美国获得了突破性的药物称号(BTD),作为为治疗目的而完全切除后的早期EGFRm NSCLC患者的术后辅助治疗。
图片来自发布
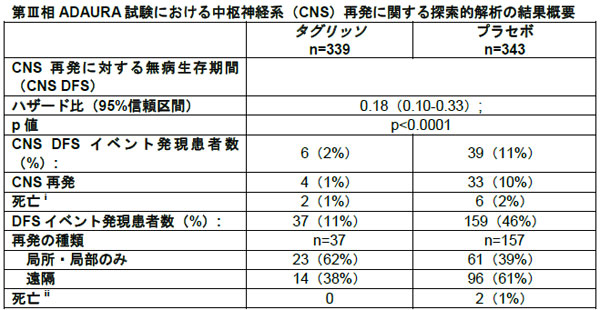
术后辅助治疗导致复发或死亡的发生率是Tagrisso 11%,安慰剂46%
该分析表明,Tagrisso治疗组的辅助治疗复发或死亡的发生率低于安慰剂治疗组(Tagrisso为11%,安慰剂为46%)。在复发患者中,安慰剂组远端器官复发患者的比例为61%,塔格列索组为38%。塔格里索将中枢神经系统复发或死亡的风险降低了82%(危险比0.18; 95%置信区间0.10-0.33; p <0.0001)。在两个治疗组中,中枢神经系统复发的无病生存期(CNS DFS)均未达到中值。
此外,在事后分析中,在18个月时大脑中复发的估计概率为未在其他部位复发的患者的9%,而接受塔格列索治疗组的患者为9%。患者少于1%。对于II期和IIIA期患者的无病生存,主要终点是塔格里索作为术后辅助治疗,可将复发或死亡的风险降低83%(危险比0.17; 95%置信区间0.12)。 -0.23; p <0.0001)。
Tagrisso在这项研究中的安全性和耐受性与先前对转移性EGFRm NSCLC的研究一致。在研究者的评估中,由于各种原因引起的3级或更高级别不良事件的发生率在安慰剂组中为3%,在塔格列索组中为10%。
▼相关链接
・阿斯特拉Zeneca Co.,Ltd.新闻稿





